Imagerie optique plein champ
Nous développons de nouvelles méthodes d’imagerie optique pour des applications essentiellement biomédicales. Nos techniques ont la particularité de fonctionner sans marquage via l’utilisation d’un contraste optique endogène basé sur la diffusion de la lumière. Nous recherchons de nouvelles manières de mesurer et de traiter cette information afin de mieux caractériser les échantillons observés. Nous sommes spécialisés dans l’imagerie interférométrique, par holographie et tomographie à cohérence optique plein champ. Celle-ci permet d’amplifier les signaux rétrodiffusés par un échantillon, de mesurer des mouvements axiaux des structures de l’échantillon à l’échelle nanométrique, et, dans le cas de la tomographie à cohérence optique d’isoler une tranche virtuelle dans la profondeur de l’échantillon.
Ces dernières années, une de nos réalisations majeures a été la mesure, l’utilisation et le contrôle de la dynamique temporelle des échantillons. Pour cela, nous nous sommes intéressés aux fluctuations de la quantité de photons diffusés. Cela nous a permis de visualiser des cellules individuelles, et d’en mesurer leur métabolisme, de mesurer et compenser les mouvements oculaires, et de quantifier des flux sanguins dans la rétine. De nombreuses applications ont pu voir le jour grâce à ces nouveaux outils. Amorcée par l’ERC Synergy Helmoltz (projet financé sur la période 2014 – 2020), une collaboration très importante avec l’hôpital des 15-20 et l’Institut de la vision nous a permis de mettre en œuvre nos technologies sur des échantillons ex-vivo et directement sur des patients.
Holographie médicale ultrarapide en temps réel
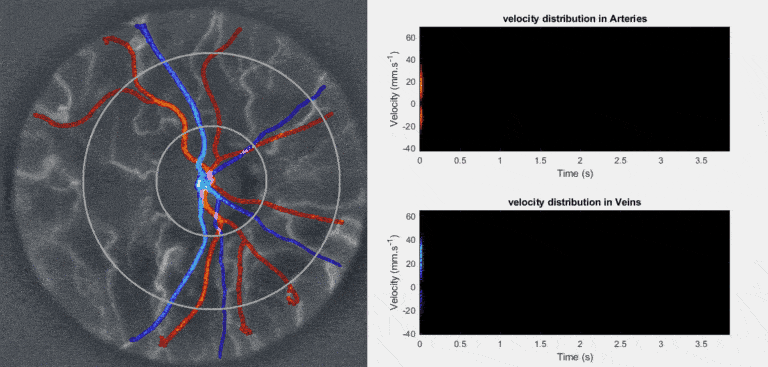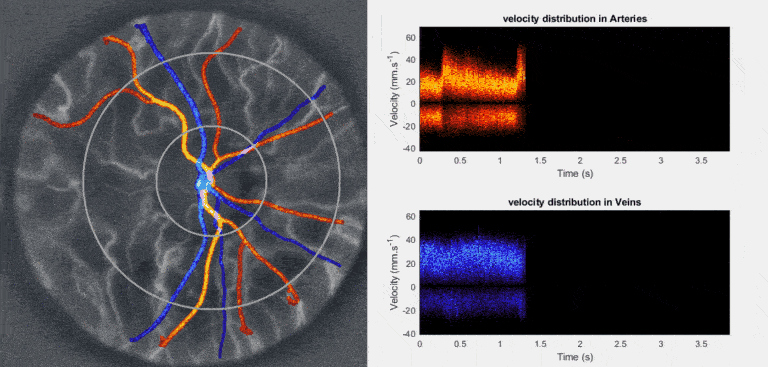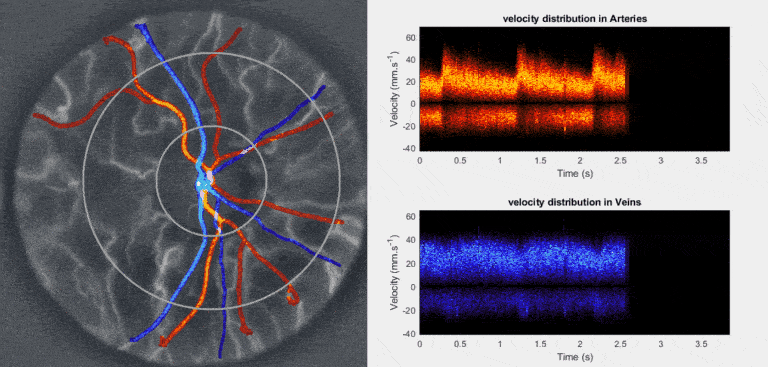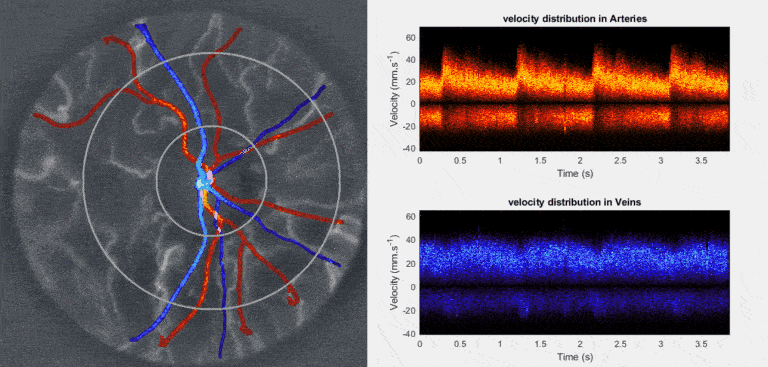
Nous développons et déployons l’holographie Doppler rétinienne ultrarapide ([https://arxiv.org/abs/1804.10066]) comme examen non invasif fonctionnel de référence de la microcirculation sanguine rétinienne ([https://arxiv.org/abs/2403.08849]). Réalisé en quelques secondes sur œil non dilaté avec une lumière proche infrarouge diffuse ([https://arxiv.org/abs/2212.13347]), cet examen restitue les ondes de vitesse du flux artériel et veineux, reflet des variations de pression de perfusion oculaire ([https://arxiv.org/abs/2409.17180]). Cette approche ouvre l’accès à des métriques hémodynamiques (débit et volume sanguin, mouvements de parois vasculaires), mécaniques (résistance, compliance, élasticité) et rhéologiques (viscosité, contrainte pariétale) jusqu’ici inédites en clinique. Une chaîne logicielle open source assure l’acquisition à haut débit en temps réel ([https://arxiv.org/abs/2508.03911], [https://github.com/DigitalHolography/Holovibes]), la reconstruction d image avec compensation d’aberrations ([https://doi.org/10.1364/BOE.528568]), l’extraction automatisée de métriques quantitatives et de biomarqueurs ([https://github.com/DigitalHolography/HoloDoppler]) et la génération d’un rapport clinique standardisé ([https://github.com/DigitalHolography/EyeFlow/]), socle des études cliniques multicentriques actuellement en cours aux États-Unis, en Europe, et en Chine. Ces métriques rigoureuses et normalisées offrent un outil puissant pour le triage, l’ajustement personnalisé des traitements et le suivi longitudinal des patients et des cohortes à grande échelle. Elles éclaireront directement les études sur les principales maladies cécitantes telles que le glaucome ([https://doi.org/10.1016/j.jfo.2024.104369]), la rétinopathie diabétique, l’occlusion veineuse rétinienne et l’ischémie oculaire, tout en étendant leur pertinence à des affections systémiques telles que les maladies cardiovasculaires. Le suivi des signatures hémodynamiques, mécaniques et rhéologiques du lit vasculaire rétinien offre un langage objectif de la santé microvasculaire et du risque vasculaire. Notre ambition est d’identifier et de valider les biomarqueurs qui permettront d’intervenir aux tout premiers stades de l’atteinte microvasculaire, lorsque la physiologie demeure réversible, afin de prévenir l’apparition des lésions structurelles plutôt que de les constater a posteriori.
Tomographie plein champ en rétrodiffusion pour le médical
Deux instruments de tomographie oculaire in vivo, avec une résolution subcellulaire ont été installés à l’Hôpital des 15-20 (Figure ci-dessous). Grâce à leur résolution subcellulaire, ils sont utilisés pour détecter des pathologies précoces de la cornée et de la rétine et pour suivre leur évolution. Pour la première fois, des images rétiniennes ont pu être acquises in vivo sur toute l’étendue de la rétine, en particulier, très près de la fovéa [Mecê et al., Biomed Opt. Ex., 2020] ; cette méthode est aussi la seule à ce jour autorisant des coupes virtuelles du trabéculum cornéen [Mazlin et al., Nat. Com, 2020]. Ces avancées ont été permises par l’imagerie rapide, ainsi que la mesure quantitative, et leur correction par rétrocontrôle des mouvements de l’œil en temps réel.
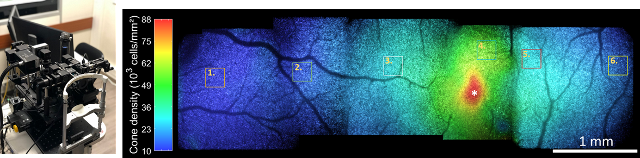
(Gauche) Image du système de Tomographie plein-champ installé à l’Hôpital des 15-20 en 2021 pour l’imagerie rétinienne à l’échelle cellulaire. (Droite) Exemple d’image acquise sur un large champ de vue, où les couleurs définissent la densité de cônes photorécepteurs mesurée grâce à la résolution atteinte par ce système.
Tomographie plein champ dynamique
En quantifiant les fluctuations du signal interférométrique obtenu en tomographie à cohérence optique [Scholler et al., Biomed. Opt. Exp., 2019], nous avons découvert un nouveau contraste, appelé contraste dynamique, qui nous permet de caractériser des cellules vivantes (Figure ci-dessous). Nous avons montré que des fluctuations intenses et rapides du signal étaient créées par le transport actif et dépendant du métabolisme, des organelles de la cellule. Nous avons pu caractériser l’origine de ce signal, améliorer son traitement [Groux et al., Com. Med., 2022], et explorer de nombreuses applications, notamment sur des explants de rétine et des biopsies tumorales avec la start-up LLTech. Nous avons développé des outils d’apprentissage et réseaux de neurones pour automatiser le diagnostic de ces échantillons cancéreux. Grâce à l’ANR OREO, nous avons récemment réalisé un module de tomographie à cohérence optique attachable à un microscope commercial permettant l’observation en 3D et sur plusieurs semaines, de toutes les cellules d’organoïdes rétiniens issus de patients permettant la modélisation de maladies rares [Scholler et al., Light Science, 2020].
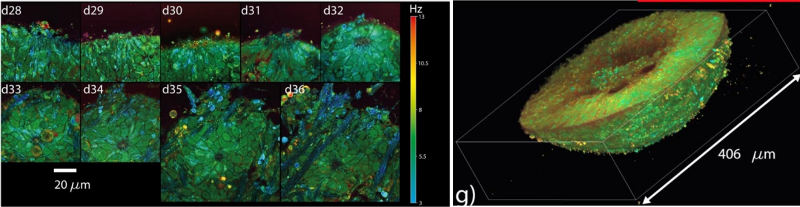
(Gauche)Suivi longitudinal de cellules en tomographie à cohérence optique dynamique dans un organoïde rétinien montrant le lieu de formations de nouvelles cellules (Droite) Imagerie 3D d’un organoïde rétinien .
En parallèle, nous avons inventé une méthode de tomographie plein champ en transmission en exploitant le déphasage de Gouy qui se produit au voisinage du foyer d’un objectif de microscope [Mazlin et al., Biomed.Opt. Ex, 2022]. Cette méthode s’est révélée très sensible car les objets biologiques diffusent préférentiellement la lumière vers l’avant (par exemple plus de 3 ordres de grandeur en termes de section efficace de diffusion pour un objet de l’ordre du micromètre). Elle nous a permis de détecter de manière spécifique des virus aussi petits que 20 nm, de distinguer des particules virales pleines et vides, et d’identifier le couplage de ces virus avec des anticorps spécifiques [Thèse Samer Alhaddad 2022][Alhaddad et al., bioRxiv, 2022.08. 23.504719]. Nous avons pu caractériser des tissus fins, des cultures de cellules, et des micro-algues, sentinelles de l’environnement . Ce montage très peu couteux a apporté des images in vivo et sans contact, des nerfs et des cellules de la cornée d’une qualité exceptionnelle.
Contacts : Olivier Thouvenin, Michael Atlan, Pédro Mécé, Claude Boccara,









